近日,賽諾菲(Sanofi)與再生元(Regeneron)聯合宣布,歐洲藥品管理局(EMA)人用醫藥產品委員會(CHMP)已發布一份積極審查意見,建議批準擴大Dupixent(中文商品名:達必妥,通用名:dupilumab,度普利尤單抗)的適用人群,用于治療適合系統療法的6-11歲中度至重度特應性皮炎(AD)兒童患者。CHMP意見是在獲得歐盟委員會(EC)批準之前營銷授權程序的最后一步。現在,CHMP的意見將遞交至EC審查,后者通常會采納CHMP的意見,并在2個月內做出最終審查決定。
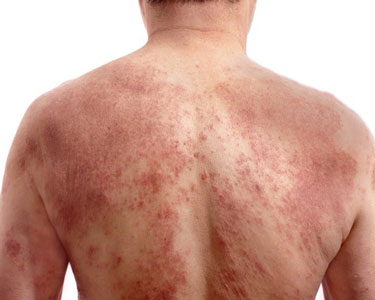
特應性皮炎(圖片來源:icresearch.net)
美國FDA批準治療6-11歲兒童以及歐盟CHMP的積極意見,均基于一項關鍵性Dupixent 兒科III期臨床研究(NCT03345914)的結果。這是一項隨機、雙盲、安慰劑對照研究,評估了Dupixent聯合標準護理局部皮質類固醇(TCS)治療兒童重度AD(平均覆蓋近60%皮膚表面)的療效和安全性。研究共入組367例病情不能通過局部藥物充分控制的6-11歲重度AD患者。總的來說,有92%的患者同時患有至少一種并發疾病,如過敏性鼻炎、哮喘和食物過敏。
在整個研究過程中,所有患者都接受TCS治療。這些患者隨機進入三個治療組,接受為期16周治療:第一組接受Dupixent每4周一次皮下注射300mg(初始劑量600mg);第二組接受Dupixent每2周一次皮下注射100mg或200mg(基于體重調整,<30公斤劑量為100mg,≥30公斤劑量為200mg),初始劑量分別為200mg或400mg;第三組接受每2周或每4周一次皮下注射安慰劑。主要終點是在16周內達到研究者總體評估(IGA)評分為0(清除)或1(幾乎清除)以及濕疹嚴重程度指數改善75%(EASI-75,美國以外的共同主要終點)的患者比例。
結果顯示,該研究達到了主要終點和次要終點。數據顯示,在重度AD兒童患者中,與TCS相比,Dupixent聯合TCS顯著改善了整體疾病嚴重程度、皮膚清除、瘙癢、健康相關生活質量的測定結果。此外,安全性數據與先前在12歲及以上患者群體中記錄到的安全性數據一致,包括與安慰劑相比皮膚感染率在數值上較低。
16周治療結果包括:(1)第一組和第二組分別有33%、30%的患者皮損達到IGA評分為0(清除)或1(幾乎清除),安慰劑組為11%(分別為:p<0.0001和p=0.0004)。(2)第一組和第二組分別有70%、67%的患者達到75%或更高的皮膚改善(EASI-75),安慰劑組為27%(均p<0.0001)。(3)第一組和第二組平均EASI評分相對基線改善82%、78%,安慰劑組為49%(均p<0.0001)。(4)Dupixent顯示出明顯的瘙癢緩解,并改善了患者報告結果的測量,如焦慮、抑郁、父母和家庭成員的健康相關生活質量。
16周治療期間,第一組和第二組不良事件總發生率為65%、67%,安慰劑組為73%。Dupixent治療更常見的不良事件包括結膜炎(第一組7%、第二組15%、安慰劑組4%)、鼻咽炎(第一組13%、第二組7%、安慰劑組7%)、注射部位反應(第一組10%、第二組11%、安慰劑組6%)。其他預先指定的不良事件包括:皮膚感染(第一組6%、第二組8%、安慰劑組13%)、皰疹病毒感染(第一組2%、第二組3%、安慰劑組5%)。
根據該結果,Dupixent是首個在這一兒科(6-11歲)AD群體中顯示出積極結果的生物制劑。
今年6月,Dupixent獲得美國FDA批準擴大適用人群,用于上述相同年齡段(6-11歲)中重度AD兒童患者。值得一提的是,Dupixent是第一個也是唯一一個在美國被批準用于≥6歲、在歐盟被批準用于≥12歲的不受控中度至重度AD患者的生物藥。
在中國,Dupixent(達必妥)于今年6月獲得國家藥監局批準,用于治療中度至重度AD成人患者。達必妥®是全球首個也是唯一獲批治療成人中重度特應性皮炎的靶向生物制劑,填補了國內臨床未被滿足的需求,能快速、顯著、持續地改善特應性皮炎患者的皮損程度和瘙癢癥狀。得益于藥監改革的推動,達必妥®提前兩年在中國獲批,為中國患者提供了全新的治療選擇。
擴展閱讀:
特應性皮炎(atopic dermatitis,AD)是一種難治性、復發性、炎癥性皮膚病,以反復發作的劇烈瘙癢和皮疹為主要臨床表現,患者常合并過敏性鼻炎、哮喘等其他特應性疾病。多數患者存在由皮膚開裂、結痂和滲液等引起的疼痛和不適癥狀,如得不到有效控制,會影響患者的情緒和心理狀態,導致焦慮和抑郁以及孤獨感。有患者曾表示,12小時不停止的劇烈瘙癢在夜里最難熬,只能不停抓,用疼痛蓋過瘙癢,一個正常睡眠都是奢侈。
(責任編輯:香港祺昌藥業)
聯系祺昌
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962