輝瑞(Pfizer)與OPKOHealth公司近日聯合宣布,美國食品和藥物管理局(FDA)已受理somatrogon的生物制品許可申請(BLA),該藥是一種長效人生長激素(hGH),每周用藥一次,用于治療生長激素缺乏癥(GHD)兒科患者。FDA已指定《處方藥用戶收費法》(PDUFA)目標日期為2021年10月。

兒童GHD是一種嚴重的罕見疾病,由垂體分泌的生長激素不足引起。GHD患兒不僅身材矮小,而且還存在代謝異常、心理社會挑戰、認知缺陷和生活質量差等問題。幾十年來,GHD的護理標準一直是每天皮下注射一次人生長激素(hGH),以改善生長和代謝影響。對于護理者和患者來說,每天注射的治療負擔很高,這可能導致依從性差,降低整體治療效果。如果獲得批準,somatrogon將有助于減輕兒童及其親人和護理者每日注射生長激素的負擔。
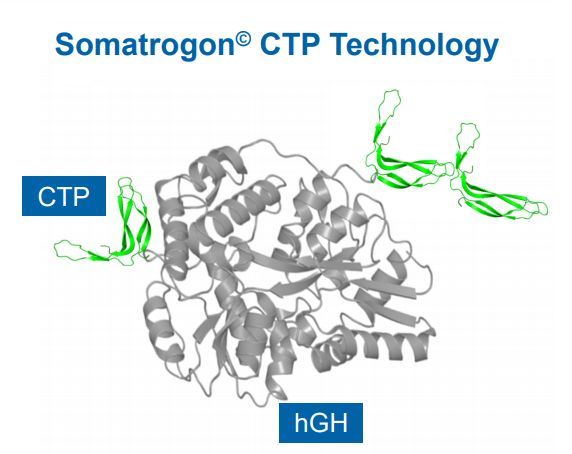
somatrogon是一種新分子實體,含有人生長激素的天然序列,并且在N端含有一個拷貝、C端含有2個拷貝的人絨毛膜促性腺激素(hCG)β鏈C端肽(CTP),CTP可延長該分子的半衰期。在美國和歐盟,somatrogon均被授予了治療GHD兒童和成人的孤兒藥資格(ODD)。迄今為止的研究結果表明,與每天一次的hGH相比,每周一次的somatrogon能顯著減少生活方式干擾、支持患者偏好、并提高依從性。
此次申請基于一項3期臨床試驗的結果支持。這是一項在20多個國家開展的隨機、開放標簽、陽性藥物對照試驗,入組并治療了224例先前沒有接受過治療的GHD兒童患者。研究中,這些患者以1:1的比例隨機分配至2個治療組:somatrogon治療組(0.66mg/kg,每周給藥一次),Genotropin(somatropin)治療組(0.034mg/kg,每天給藥一次)。試驗的主要終點是治療12個月的身高生長速度(height velocity)。次要終點包括6個月和12個月時身高標準差的變化、安全性、藥效學指標。完成該研究的兒童有機會參加一項全球性的、開放標簽、多中心、長期擴展研究,在這項研究中,患者可以繼續接受或改用somatrogon治療。大約95%的患者已轉入開放標簽擴展研究,并接受了somatrogon治療。
結果顯示,該研究達到了非劣效性主要終點:治療12個月,somatrogon組的最小二乘平均值(10.12 厘米/年)高于Genotropin組(9.78厘米/年);身高生長速度(厘米/年)的治療差異(somatrogon-Genotropin)為0.33(雙側95%置信區間:-0.39,1.05)。與Genotropin組相比,somatrogon組在6個月和12個月時的身高標準差得分變化(關鍵次要終點)更高。此外,在6個月時,與Genotropin組相比,somatrogon組在另一個關鍵次要終點——身高生長速度變化更高。在臨床環境中,這些常用的生長測量方法用于測量受試者可能經歷的追趕年齡和性別匹配的同齡人身高生長的潛力。
該研究中,somatrogon的耐受性總體良好,在各治療組之間觀察到的不良事件的類型、數量和嚴重程度方面,與每天一次的生長激素Genotropin相當。
24小時服務熱線:(086)150 1799 1962 / (086)189 2841 1962
